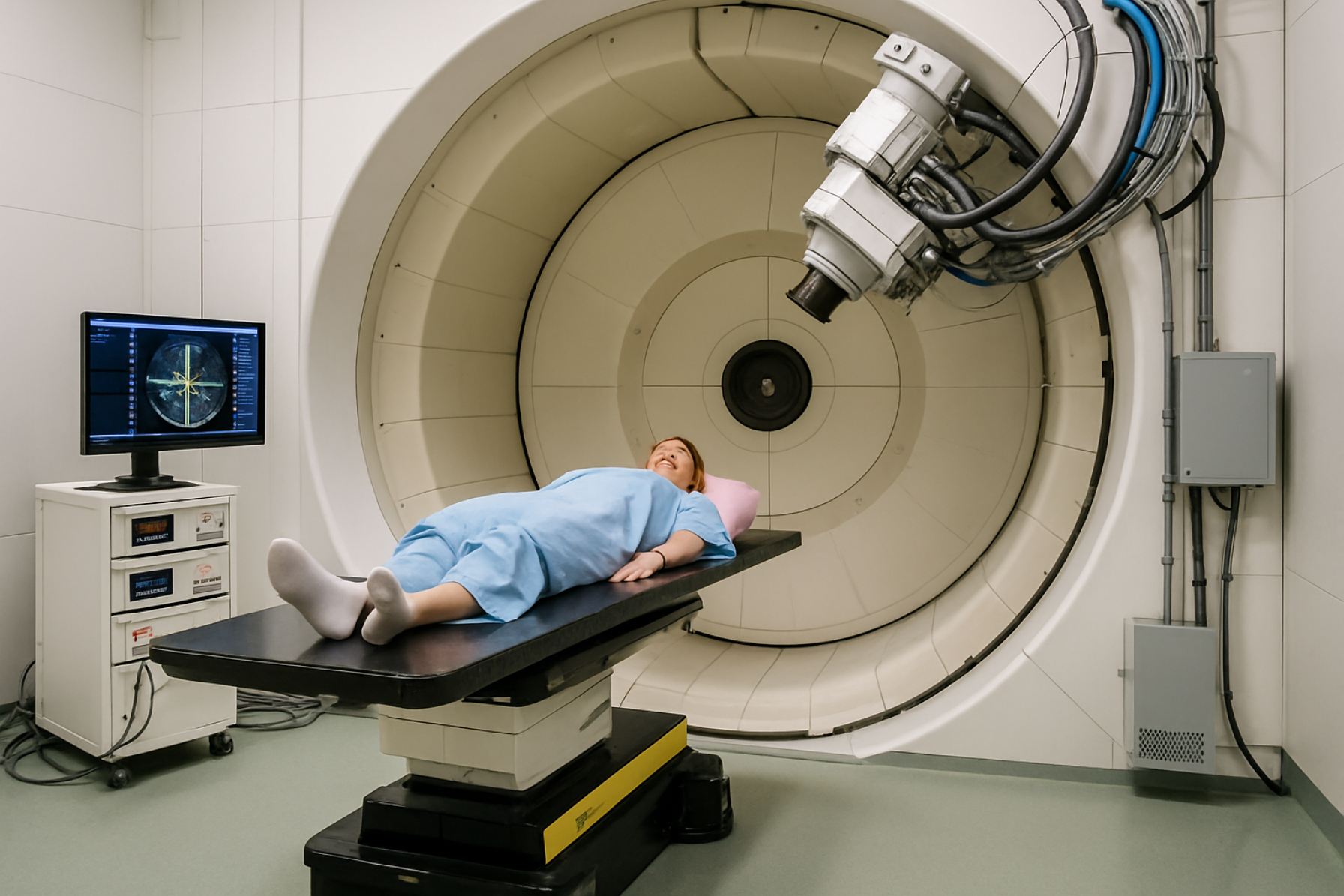
Системы терапии тяжелыми ионами в 2025 году: высвобождение прецизионной онкологии и расширение рынка. Узнайте, как передовая частичная терапия формирует следующую эпоху лечения рака.
- Исполнительное резюме: Ключевые выводы и прогноз на 2025 год
- Обзор рынка: Пейзаж систем терапии тяжелыми ионами
- Прогноз роста 2025–2030: CAGR, Прогнозы доходов и региональные горячие точки
- Технологические достижения: Ускорители нового поколения, Технология доставки пучка и интеграция изображений
- Конкурентный анализ: Ведущие игроки, Новые участники и Стратегические альянсы
- Регуляторная среда и тенденции возмещения
- Клинические приложения: Расширение показаний и результаты для пациентов
- Тенденции инвестиций и финансирования в терапии тяжелыми ионами
- Проблемы и препятствия: Стоимость, Инфраструктура и доступность
- Будущий обзор: Разрушительные инновации и рыночные возможности после 2025 года
- Источники и ссылки
Исполнительное резюме: Ключевые выводы и прогноз на 2025 год
Системы терапии тяжелыми ионами представляют собой передовое достижение в области лечения рака, используя ускоренные тяжелые ионы—такие как углеродные ионы—для целенаправленного уничтожения злокачественных клеток с высокой точностью. В 2025 году глобальный рынок систем терапии тяжелыми ионами характеризуется значительным технологическим прогрессом, расширением клинического применения и ростом инвестиций как из публичного, так и из частного секторов. Ключевые выводы показывают, что спрос на терапию тяжелыми ионами обусловлен ее превосходным распределением дозы и биологической эффективностью по сравнению с традиционной фотонной и даже протонной терапиями, что делает ее особенно ценной для лечения радиорезистентных и глубоко расположенных опухолей.
Крупные производители и поставщики технологий, включая Hitachi, Ltd., Siemens Healthineers AG и Toshiba Energy Systems & Solutions Corporation, ускорили инновации в миниатюризации систем, точности доставки пучка и пропускной способности пациентов. Эти достижения снижают общий объем и эксплуатационные расходы центров терапии тяжелыми ионами, делая технологию более доступной для более широкого круга медицинских учреждений.
Географически регион Азиатско-Тихоокеанского региона—возглавляемый Японией и Китаем—по-прежнему доминирует на рынке, поддерживаемый надежным государственным финансированием и растущей сетью клинических центров. Европа также наблюдает за увеличением уровня принятия, с новыми объектами в стадии разработки и сильной поддержкой со стороны таких организаций, как GSI Helmholtzzentrum für Schwerionenforschung и Helmholtz Zentrum München. В Северной Америке интерес растет, хотя принятие остается ограниченным из-за высоких капитальных затрат и регуляторных препятствий.
Смотрим в будущее на 2025 год, прогноз для систем терапии тяжелыми ионами остается оптимистичным. Ожидается, что продолжающиеся клинические испытания дальнейшим образом подтвердят эффективность и безопасность терапии тяжелыми ионами для более широкого круга видов рака, потенциально расширяя охват возмещения и ускоряя рост рынка. Ожидается, что стратегические сотрудничества между поставщиками технологий, исследовательскими учреждениями и медицинскими сетями будут стимулировать дальнейшие инновации и упрощать интеграцию терапии тяжелыми ионами в стандартную онкологическую практику. В результате сектор готов к устойчивому расширению, сосредоточив внимание на улучшении результатов для пациентов и операционной эффективности.
Обзор рынка: Пейзаж систем терапии тяжелыми ионами
Системы терапии тяжелыми ионами представляют собой передовое достижение в области радиационной онкологии, используя заряженные частицы—чаще всего углеродные ионы—для целенаправленного уничтожения злокачественных тканей с высокой точностью. На 2025 год глобальный рынок систем терапии тяжелыми ионами характеризуется сочетанием технологических инноваций, расширяющегося клинического применения и значительных капитальных инвестиций. В отличие от традиционной фотонной радиотерапии или даже протонной терапии, терапия тяжелыми ионами предлагает превосходное распределение дозы и увеличенную биологическую эффективность, что делает ее особенно ценной для лечения радиорезистентных и глубоко расположенных опухолей.
Рынок систем терапии тяжелыми ионами остается относительно нишевым по сравнению с другими методами радиотерапии, в первую очередь из-за высоких затрат, связанных с установкой, эксплуатацией и обслуживанием систем. Эти системы требуют инфраструктуры большого масштаба, включая ускорители частиц и сложные механизмы доставки пучка, что ограничивает их развертывание специализированными центрами, в основном в Азии и Европе. Заметные установки и текущие проекты можно найти в таких учреждениях, как Национальные институты квантовой науки и технологии (QST) в Японии, Центр терапии ионов в Гейдельберге (HIT) в Германии и Университет Цинхуа в Китае.
В последние годы рынок столкнулся с увеличением интереса как со стороны публичного, так и частного секторов, поскольку правительства и поставщики медицинских услуг признают клинические преимущества и долгосрочную экономическую эффективность терапии тяжелыми ионами для определенных групп пациентов. Такие компании, как Hitachi, Ltd., Siemens Healthineers и Toshiba Energy Systems & Solutions Corporation активно участвуют в разработке и внедрении решений для терапии тяжелыми ионами, часто в партнерстве с академическими и исследовательскими учреждениями.
Смотрим в будущее на 2025 год, ожидается, что рынок систем терапии тяжелыми ионами будет расти устойчиво, движимый продолжающимися клиническими испытаниями, технологическими достижениями в проектировании ускорителей и растущим осознанием среди онкологов. Однако широкое принятие продолжит сдерживаться финансовыми и логистическими барьерами, а также необходимостью в дальнейших доказательствах, поддерживающих клинические результаты для более широкого круга видов рака. Стратегические партнерства, государственное финансирование и международные сотрудничества, вероятно, сыграют ключевую роль в формировании будущего пейзажа терапии тяжелыми ионами по всему миру.
Прогноз роста 2025–2030: CAGR, Прогнозы доходов и региональные горячие точки
Глобальный рынок систем терапии тяжелыми ионами готов к значительному расширению в период с 2025 по 2030 год, движимый технологическими достижениями, растущей заболеваемостью раком и увеличением принятия прецизионной онкологии. Аналитики отрасли прогнозируют среднегодовой темп роста (CAGR) в диапазоне от 8% до 12% в этот период, при этом глобальные доходы должны превысить 1,5 миллиарда долларов США к 2030 году. Этот рост поддерживается растущими инвестициями в современную инфраструктуру радиотерапии и продемонстрированными клиническими преимуществами терапии тяжелыми ионами, особенно для радиорезистентных и глубоко расположенных опухолей.
Географически ожидается, что регион Азиатско-Тихоокеанского региона останется доминирующей горячей точкой, возглавляемой Японией и Китаем. Япония, дом для таких пионерских учреждений, как Национальные институты квантовой науки и технологии, продолжает расширять свою сеть центров терапии тяжелыми ионами, в то время как Китай быстро увеличивает установки благодаря инициативам, поддерживаемым правительством, и совместным проектам с глобальными поставщиками технологий. Европа также наблюдает значительный рост, причем Германия и Италия инвестируют в новые объекты и исследовательские программы, поддерживаемые такими организациями, как Хельмгольц Ассоциация и CNAO (Национальный центр онкологическойhadronтерапии).
Северная Америка, хотя в настоящее время и отстает по количеству установленных систем, ожидается, что ускорит принятие после 2025 года, поскольку регуляторные пути становятся яснее, а основные центры лечения рака стремятся дифференцировать себя с помощью методов лечения следующего поколения. Соединенные Штаты, в частности, наблюдают за ростом интереса со стороны академических медицинских центров и частных медицинских сетей с поддержкой таких организаций, как Национальный институт рака.
Ключевыми факторами, способствующими этому прогнозируемому росту, являются продолжающиеся улучшения в технологии ускорителей, сокращение размеров системы и затрат, а также расширение клинических доказательств, поддерживающих эффективность терапии тяжелыми ионами для сложных раков. Кроме того, государственно-частные партнерства и международные сотрудничества способствуют передаче знаний и развитию инфраструктуры, что дополнительно содействует расширению рынка.
В заключение, период 2025–2030 года должен стать свидетелем ускоренного роста на рынке систем терапии тяжелыми ионами, при этом Азиатско-Тихоокеанский регион будет лидировать по установкам и инновациям, Европа будет консолидировать свои лидерские позиции в исследованиях, а Северная Америка станет новым фронтом роста. Эти тенденции подчеркивают растущее глобальное признание терапии тяжелыми ионами как критически важного компонента передового ухода за раком.
Технологические достижения: Ускорители нового поколения, Технология доставки пучка и интеграция изображений
Системы терапии тяжелыми ионами находятся на передовой инноваций в лечении рака, используя уникальные физические и биологические свойства тяжелых ионов—таких как углерод—для доставки высоко целевых доз радиации. Недавние технологические достижения быстро трансформируют пейзаж этих систем, особенно в областях ускорителей нового поколения, механизмов доставки пучка и интеграции передовых методов визуализации.
Ускорители нового поколения являются центральными для повышения эффективности и доступности терапии тяжелыми ионами. Традиционные синхротроны и циклотрон, хотя и эффективны, являются большими и дорогостоящими. Последние разработки сосредоточены на компактных конструкциях ускорителей, таких как сверхпроводящие синхротроны и линейные ускорители, которые уменьшают размеры объектов и эксплуатационные расходы без ущерба для качества пучка. Например, Центр терапии ионов в Гейдельберге (HIT) и Национальные институты квантовой науки и технологии (QST) активно исследуют и внедряют эти компактные системы, стремясь сделать терапию тяжелыми ионами более доступной.
Технология доставки пучка также достигла значительного прогресса. Сканирование пучком (PBS) позволяет точно, слой за слоем, наносить дозу, минимизируя воздействие на окружающие здоровые ткани. Инновации в мониторинге пучка в реальном времени и адаптивной доставке позволяют клиницистам динамически корректировать лечение, учитывая движение пациента и анатомические изменения. Такие компании, как Siemens Healthineers и Hitachi, Ltd., находятся на передовой разработки этих передовых решений по доставке пучка, интегрируя сложные системы управления для повышения безопасности и точности.
Интеграция передовых методов визуализации является еще одним критическим достижением. Визуализация в реальном времени, такая как КТ, МРТ и ПЭТ, все чаще включается в рабочие процессы терапии тяжелыми ионами. Эта интеграция позволяет добиться точной локализации опухоли, верификации диапазона ионов и адаптивного планирования лечения. Например, Varian Medical Systems и Elekta AB разрабатывают платформы, которые бесшовно объединяют визуализацию и терапию, поддерживая персонализированные и адаптивные методы лечения.
В совокупности эти технологические достижения стимулируют эволюцию систем терапии тяжелыми ионами в 2025 году, обещая большую точность, безопасность и доступность для пациентов по всему миру.
Конкурентный анализ: Ведущие игроки, Новые участники и Стратегические альянсы
Глобальный рынок систем терапии тяжелыми ионами характеризуется концентрацией группы устоявшихся игроков, растущим числом новых участников и динамичным ландшафтом стратегических альянсов. Ведущие компании, такие как Hitachi, Ltd., Siemens Healthineers AG и Shimadzu Corporation, сохраняют свое господство благодаря обширным инвестициям в НИОКР, надежным портфелям и успешным установкам в основных центрах лечения рака по всему миру. Эти компании используют собственные технологии ускорителей, интегрированные программные продукты для планирования лечения и комплексные услуги, чтобы отличаться в рынке, где техническая надежность и клинические результаты имеют первостепенное значение.
Новые участники, особенно из Азии и Европы, усиливают конкуренцию. Такие компании, как Toshiba Energy Systems & Solutions Corporation и Ion Beam Applications S.A. (IBA), расширяют свое присутствие, предлагая модульные системы по доступной цене, направленные на расширение доступа к терапии тяжлыми ионами для больниц среднего размера и развивающихся рынков. Эти участники часто фокусируются на технологических инновациях, таких как компактные синхротроны, улучшенные системы доставки пучка и усовершенствованные решения для позиционирования пациентов, чтобы решить высокие капитальные и эксплуатационные затраты, традиционно связанные с терапией тяжелыми ионами.
Стратегические альянсы и сотрудничество являются определяющей чертой сектора в 2025 году. Партнерства между поставщиками технологий, академическими учреждениями и медицинскими организациями ускоряют темпы клинических исследований и развертывания систем. Например, Hitachi, Ltd. вступила в несколько совместных предприятий с ведущими центрами раковых исследований для совместной разработки протоколов лечения следующего поколения и расширения клинических показаний. Аналогично, Siemens Healthineers AG сотрудничает с университетскими больницами для интеграции искусственного интеллекта в планирование лечения и мониторинг результатов.
Конкурентный ландшафт также формируется за счет инициатив, поддерживаемых государством, особенно в Японии, Германии и Китае, где государственное финансирование поддерживает создание новых центров терапии тяжелыми ионами и содействует государственно-частным партнерствам. По мере成熟ления рынка взаимодействие между устоявшимися лидерами, инновационными новичками и коллаборативными сетями ожидается, что будет стимулировать технологические достижения, сокращение затрат и более широкое принятие систем терапии тяжелыми ионами в мировом масштабе.
Регуляторная среда и тенденции возмещения
Регуляторная среда для систем терапии тяжелыми ионами в 2025 году характеризуется развивающимися стандартами и растущим вниманием, что отражает сложность и высокую стоимость этих передовых технологий лечения рака. Регуляторные органы, такие как Управление по контролю за продуктами и лекарствами США и Европейское агентство по лекарственным средствам, требуют комплексных клинических доказательств для подтверждения безопасности, эффективности и долгосрочных результатов перед предоставлением разрешения на выход на рынок. В Соединенных Штатах системы терапии тяжлыми ионами обычно классифицируются как медицинские устройства класса II или III, что требует строгих процессов предварительного одобрения (PMA) или получения разрешения 510(k). Эти пути требуют наличия надежных данных клинических испытаний, часто включая многоцентровые исследования, для проверки терапевтических преимуществ по сравнению с существующими методами, такими как протонная терапия.
В Европе Регламент о медицинских устройствах (MDR) ввел более строгие требования к клинической оценке и постреализационному мониторингу, что влияет на скорость и стоимость выведения систем терапии тяжелыми ионами на рынок. Производители должны тесно сотрудничать с назначенными органами и поддерживать подробную техническую документацию, включая оценку рисков и данные о реальной производительности. Япония, являясь лидером в принятии терапии тяжелыми ионами, установила собственную регуляторную структуру через Агентство фармацевтической и медицинской продукции (PMDA), которое акцентирует внимание как на клинической эффективности, так и на интеграции стандартов внутреннего производства.
Тенденции возмещения являются критическим фактором, влияющим на принятие систем терапии тяжелыми ионами. В США решения по покрытию со стороны Центров Medicare и Medicaid и частных страховщиков зависят от продемонстрированной клинической выгоды и экономической эффективности. На 2025 год возмещение за терапию тяжелыми ионами остается ограниченным, при этом большинство страховщиков требует доказательств превосходства по сравнению с традиционной радиотерапией или протонной терапией для определенных показаний рака. В Европе национальные системы здравоохранения таких стран, как Германия и Италия, начали предлагать частичное возмещение за терапию тяжелыми ионами, особенно для редких или радиорезистентных опухолей, однако комплексное покрытие все еще находится на оценке.
Глобально высокие капитальные и эксплуатационные расходы центров терапии тяжелыми ионами представляют собой проблемы для широкого возмещения. Однако ожидается, что продолжающиеся клинические испытания и оценки технологий здравоохранения будут формировать будущие полисные решения, потенциально расширяя доступ по мере появления более надежных доказательств. Сотрудничество между производителями, регуляторными органами и страховщиками будет иметь решающее значение для оптимизации процессов одобрения и разработки устойчивых моделей возмещения для этого передового лечения рака.
Клинические приложения: Расширение показаний и результаты для пациентов
Системы терапии тяжелыми ионами, особенно использующие углеродные ионы, все чаще признаются за их расширяющиеся клинические применения и потенциал улучшения результатов лечения для пациентов в онкологии. В отличие от традиционной фотонной или даже протонной терапии, терапия тяжелыми ионами предлагает превосходное распределение дозы и более высокую относительную биологическую эффективность (RBE), что делает ее особенно ценной для лечения радиорезистентных и глубоко расположенных опухолей. В последние годы расширились показания, при этом клинические испытания и реальные лечения нацелены на злокачественные опухоли, такие как раки головы и шеи, саркомы, рак поджелудочной железы и рецидивирующие опухоли, которые не поддались предыдущей радиотерапии.
Например, Национальные институты квантовой науки и технологии (QST) в Японии сообщили о многообещающих результатах в лечении местно распространенного рака поджелудочной железы, болезни с исторически плохим прогнозом, используя терапию углеродными ионами. Аналогично, Университетская клиника Гейдельберга в Германии расширила свои клинические протоколы, чтобы включить опухоли у детей и случаи повторной облучения, используя точность тяжелых ионов для минимизации повреждений окружающим здоровым тканям.
Результаты лечения пациентов являются центральной темой продолжающихся исследований. Исследования из Национального центра рака в Японии и Университета Гейдельберга продемонстрировали улучшенные показатели локального контроля и, в некоторых случаях, преимущества общей выживаемости для пациентов с операбельными или рецидивирующими опухолями. Что важно, сниженный профиль токсичности терапии тяжелыми ионами позволяет безопасно доставлять более высокие дозы, что особенно полезно в анатомически сложных областях или у пациентов с ограниченными вариантами лечения.
Расширение клинических показаний также поддерживается технологическими достижениями в планировании и доставке лечения, такими как адаптивная терапия с управлением изображениями и модульная терапия тяжелыми ионами. Эти инновации, разработанные такими учреждениями, как Центр терапии ионов в Гейдельберге (HIT), позволяют выполнять более персонализированные и эффективные лечения.
По мере того как все больше центров по всему миру, включая те, что находятся в Европе и Азии, принимают системы терапии тяжелыми ионами, объем доказательств, поддерживающих их использование, продолжает расти. Ожидается, что продолжающиеся многоцентровые испытания и регистры进一步 прояснят долгосрочные преимущества и оптимальные показания, потенциально устанавливая терапию тяжелыми ионами в качестве стандарта лечения для отдельных пациентских групп к 2025 году и далее.
Тенденции инвестиций и финансирования в терапии тяжелыми ионами
Тенденции инвестиций и финансирования в системах терапии тяжелыми ионами значительно изменились, поскольку технология созревает и клинические доказательства, поддерживающие ее эффективность, растут. Терапия тяжелыми ионами, особенно с углеродными ионами, предлагает явные преимущества по сравнению с традиционными фотонными и протонными терапиями, включая более высокую биологическую эффективность и улучшенное распределение дозы для определенных устойчивых опухолей. Эти клинические плюсы привлекли растущее внимание как со стороны публичного, так и частного секторов, формируя ландшафт финансирования на 2025 год.
Исторически высокие капитальные и эксплуатационные затраты, связанные с системами терапии тяжелыми ионами, ограничили их применение до небольшого числа поддерживаемых государством исследовательских центров, особенно в Японии и Европе. Однако в последние годы наблюдается сдвиг, когда более разнообразные источники финансирования становятся доступными. Национальные правительства продолжают играть важную роль, при этом такие страны, как Япония, Германия и Китай, вкладывают значительные средства в новые объекты и исследования через свои соответствующие министерства здравоохранения и науки (Национальные институты квантовой науки и технологии, GSI Helmholtzzentrum für Schwerionenforschung).
Частные инвестиции также увеличиваются, вызванные входом устоявшихся производителей медицинских устройств и новых стартапов в технологии. Такие компании, как Hitachi, Ltd. и Siemens Healthineers, расширяют свои портфели, включая решения для терапии тяжелыми ионами, часто сотрудничая с больницами и исследовательскими учреждениями для совместного финансирования новых центров. Эти сотрудничества часто поддерживаются моделями государственного-частного партнерства, которые помогают распределять финансовые риски и усовершенствовать передачу технологий.
Венчурный капитал и стратегические инвесторы все больше интересуются потенциальными возможностями для мировой рыночной экспансии, особенно по мере того, как регулировочные одобрения в Соединенных Штатах и других регионах становятся более достижимыми. В 2025 году несколько компаний на ранних стадиях фокусируются на сокращении размеров и затрат систем, стремясь сделать терапию тяжелыми ионами более доступной для более широкого круга поставщиков медицинских услуг. Эта тенденция поддерживается инновационными грантами и финансированием трансляционных исследований от таких организаций, как Национальные институты здоровья и Национальный институт рака.
В целом, инвестиционный ландшафт для систем терапии тяжелыми ионами в 2025 году характеризуется сочетанием продолжительного государственного финансирования, растущего участия частного сектора и акцентом на технологические инновации для расширения применения и повышения результатов лечения пациентов.
Проблемы и препятствия: Стоимость, Инфраструктура и доступность
Системы терапии тяжелыми ионами, которые используют заряженные частицы, такие как углеродные ионы, для лечения рака, имеют большой потенциал благодаря превосходному распределению дозы и биологической эффективности по сравнению с традиционными фотонными или даже протонными терапиями. Однако широкое применение сталкивается с значительными вызовами, в первую очередь связанными со стоимостью, инфраструктурой и доступностью.
Начальные капитальные инвестиции для центров терапии тяжелыми ионами чрезвычайно высоки. Строительство объекта требует современных ускорителей частиц, сложных систем доставки пучка и обширного радиационного экранирования. Общая стоимость может превышать несколько сотен миллионов долларов, что делает ее непосильной для большинства больниц и систем здравоохранения. Например, Национальные институты квантовой науки и технологии в Японии, лидирующие в терапии тяжелыми ионами, инвестировали значительные средства как в инфраструктуру, так и в текущие эксплуатационные расходы, которые включают обслуживание сложного оборудования и высококвалифицированного персонала.
Требования к инфраструктуре еще больше усложняют развертывание. Ускорители тяжелых ионов большие и требуют значительного физического пространства, надежного электроснабжения и специализированного инженерного экспертиза для установки и эксплуатации. Ретро-фит существующих больниц редко осуществим, что требует создания объектов по назначению. Это ограничивает число центров, которые могут быть созданы, особенно в регионах с ограниченными бюджетами на здравоохранение или технической экспертизой. Такие организации, как Helmholtz Zentrum München и GSI Helmholtzzentrum für Schwerionenforschung в Германии, подчеркнули логистические и технические препятствия, связанные с расширением инфраструктуры терапии тяжелыми ионами.
Доступность остается серьезным препятствием. Из-за недостатка действующих центров—в основном расположенных в Японии, Германии и нескольких других странах—пациенты часто сталкиваются с большими расстояниями для поездок и долгими сроками ожидания. Эта географическая концентрация ограничивает доступ для многих, особенно для людей в странах с низким и средним доходом. Кроме того, высокая стоимость лечения, часто не полностью покрываемая страховкой, дополнительно ограничивает доступ пациентов. Усилия таких организаций, как Международное агентство по атомной энергии, направлены на устранение этих различий, продвигая международное сотрудничество и обмен знаниями, но значительные пробелы остаются.
В заключение, хотя системы терапии тяжелыми ионами предлагают передовые возможности лечения рака, их высокая стоимость, требовательная инфраструктура и ограниченная доступность представляют собой значительные барьеры для более широкого применения. Преодоление этихChallenges will require coordinated efforts in technological innovation, funding, and international cooperation.
Будущий обзор: Разрушительные инновации и рыночные возможности после 2025 года
Смотрим за пределы 2025 года, будущее систем терапии тяжелыми ионами готово к значительной трансформации, движимой разрушительными инновациями и расширяющимися рыночными возможностями. Терапия тяжелыми ионами, использующая заряженные частицы, такие как углеродные ионы, для лечения рака, признается за превосходное распределение дозы и биологическую эффективность по сравнению с традиционной фотонной и протонной терапиями. Поскольку накапливаются исследования и клинический опыт, ожидается, что несколько тенденций сформируют пейзаж этой передовой методики.
Одной из наиболее многообещающих областей инноваций является уменьшение размеров и снижение затрат на технологии ускорителей. Традиционные центры терапии тяжелыми ионами требуют больших, сложных и дорогих синхротронов или циклотронов. Однако новые компактные проектировки ускорителей, такие как сверхпроводящие синхротроны и лазерные источники ионов, развиваются такими организациями, как Национальные институты квантовой науки и технологии (QST) и Центр медицинских тяжелых ионов Гумна. Эти достижения могут сделать терапию тяжелыми ионами более доступной для более широкого круга больниц и центров рака по всему миру.
Искусственный интеллект (AI) и передовая визуализация также готовы сыграть ключевую роль в эволюции терапии тяжелыми ионами. Планы лечения, основанные на AI, адаптивная терапия в реальном времени и улучшенные алгоритмы выбора пациентов исследуются исследовательскими учреждениями и поставщиками технологий, такими как Siemens Healthineers и Varian, компания Siemens Healthineers. Эти инструменты обещают повысить точность, снизить побочные эффекты и оптимизировать клинические результаты.
На клиническом фронте продолжающиеся и будущие испытания, скорее всего, расширят показания для терапии тяжелыми ионами за пределами текущих применений для радиорезистентных и глубоко расположенных опухолей. Растет интерес к комбинированию терапии тяжелыми ионами с иммунотерапиями и таргетными препаратами, потенциально раскрывая синергетические эффекты для сложных раков. Коллаборативные усилия организаций, таких как Европейский институт биоинформатики (EMBL-EBI) и Helmholtz Zentrum München, ускоряют трансляционные исследования в этой области.
Ожидается, что рыночные возможности будут расти, особенно в Азии и Европе, где поддерживаемые государством инвестиции и государственно-частные партнерства содействуют строительству новых центров. По мере того как регуляторные пути становятся яснее и модели возмещения эволюционируют, ожидается, что глобальный рынок терапии тяжелыми ионами расширится, новые участники и устоявшиеся компании будут искать возможности капитализировать клинический и коммерческий потенциал технологии.
Источники и ссылки
- Hitachi, Ltd.
- Siemens Healthineers AG
- GSI Helmholtzzentrum für Schwerionenforschung
- Helmholtz Zentrum München
- Национальные институты квантовой науки и технологии (QST)
- Хельмгольц Ассоциация
- Национальный институт рака
- Varian Medical Systems
- Elekta AB
- Shimadzu Corporation
- Европейское агентство по лекарственным средствам
- Регламент о медицинских устройствах (MDR)
- Агентство фармацевтической и медицинской продукции (PMDA)
- Центры Medicare и Medicaid
- Университетская больница Гейдельберга
- Национальный центр рака
- Национальные институты здоровья
- Международное агентство по атомной энергии
- Европейский институт биоинформатики (EMBL-EBI)